筑波大学脳神経内科が行っている臨床・基礎研究を紹介します。

ご寄附のお願い
私たちの教室では、パーキンソン病などの神経疾患に関する研究の推進を目的として、寄附によるご支援をお願いしております。これらの研究を継続・発展させていくうえで、皆さまのお力添えをいただけましたら幸いです。趣旨にご賛同いただけるようでしたら、ご協力のほどよろしくお願い申し上げます。
筑波大学基金を通じた寄付を行うと、所得税、法人税の税制上の優遇措置が受けられます。優遇措置の詳細については「税制上の優遇措置」をご覧ください。
ご寄付の方法

筑波大学基金のページにアクセスして頂き、右上にある「寄附する」ボタンをクリックしてください。
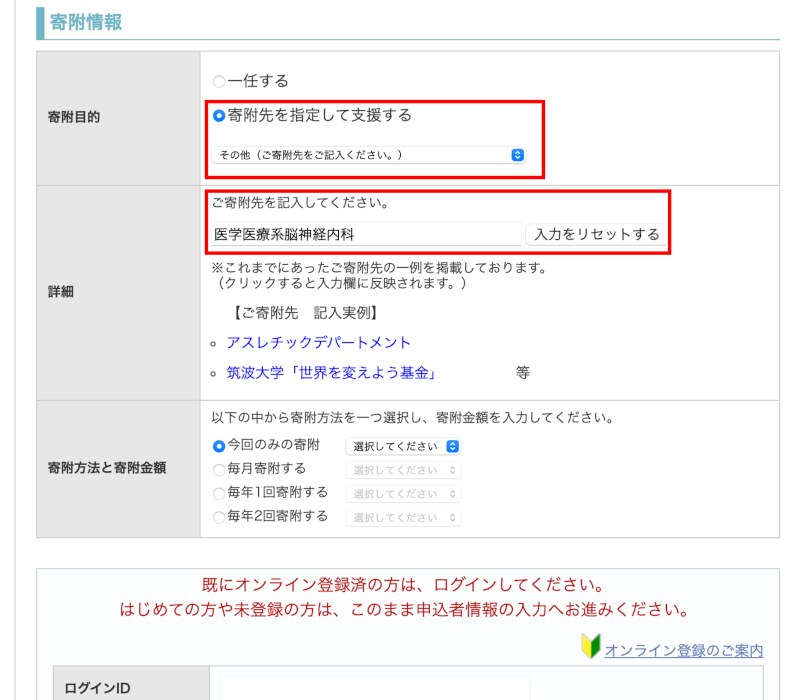
寄附目的の欄で
①「その他の寄附目的」を選択してください
②「その他(ご寄附先をご記入ください。)」を選択してください
詳細の欄で
③「医学医療系脳神経内科」と入力してください
その後は、表記されている項目の選択や入力をお願いいたします。






