斉木臣二
私は前任地の順天堂大学より2023年1月に当科に着任しました。現在、前任地の大学院生指導を行うと共に、当教室では下記2つのテーマを実施する体制構築を進めています。
I. 現在実施している研究
①神経変性疾患バイオマーカーに基づく臨床研究
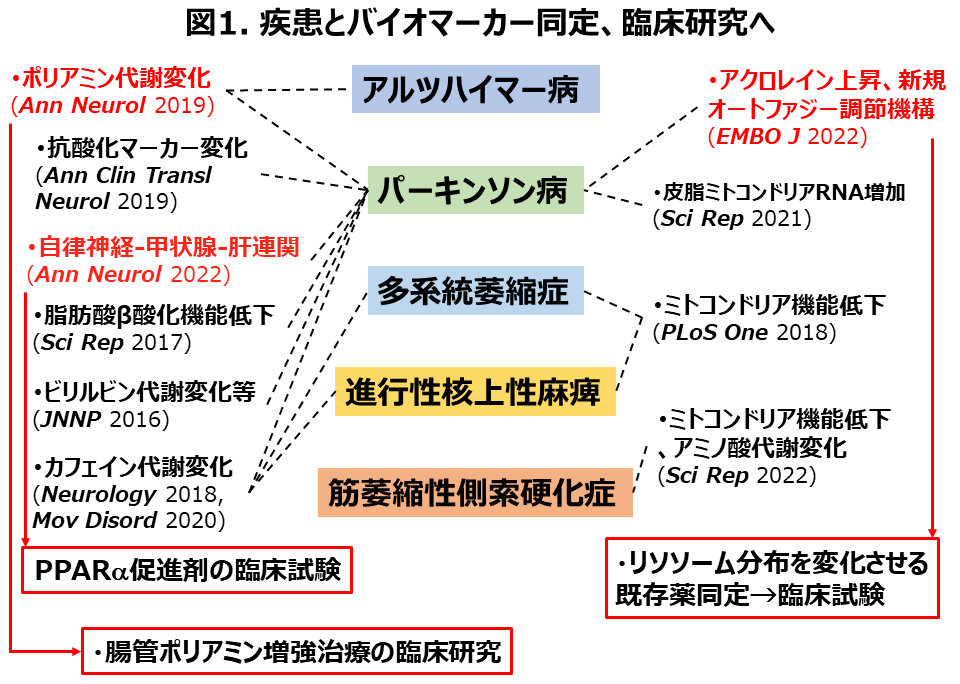
現在のパーキンソン病(PD)の診断は、臨床症状・画像検査や, パーキンソン病治療薬での症状の改善を評価することによって行われます。またアルツハイマー病(AD)の診断は、臨床症状や画像検査,髄液・血液中のアミロイドβ*1の評価によってなされます。私はより簡便かつ迅速に診断できるバイオマーカーが必要と考えました。パーキンソン病では,震えや動きの遅さなどの運動症状に加えて,便秘や起立性低血圧など,自律神経の障害による症状が現れます。皮脂は末梢神経障害で分泌調節されており、パーキンソン病においては,脂漏性皮膚炎など皮脂の増加を反映する皮膚炎が多くみられます。
このため,私は血液サンプルに加え、花王株式会社とも協力し*2、脂取りフィルムで顔から採取した皮脂をサンプルとしてバイオマーカー研究を進め、簡易診断可能なマーカーを特定しています(図1,1-7)。その中で、PD病態に直結すると考えられる2つ(脂肪酸β酸化機能低下、ポリアミン代謝変化)を是正する臨床研究(3つの赤枠)を予定しています。
②オートファジー促進薬の開発研究
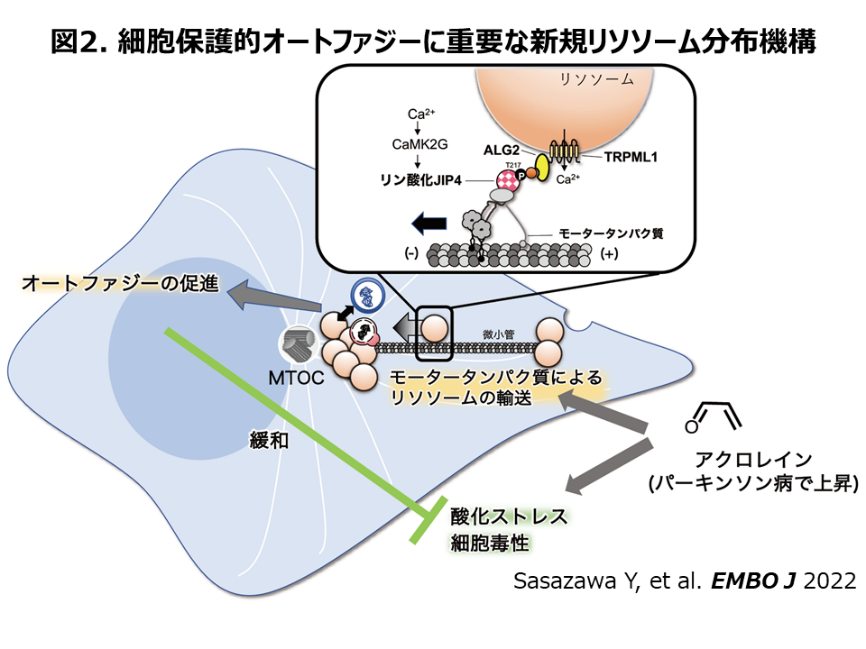
多くの神経変性疾患に共通する病理学的特徴の一つとして、神経細胞質内に異常蛋白凝集体が認められることが挙げられます。これら蛋白凝集体の中で、異常伸長ポリグルタミン、a-synucleinなどがオートファジーの基質であること、さらに実験的にコンディショナルオートファジー欠損マウスで神経細胞内蛋白凝集体が形成され進行性神経細胞死にもとづく脱落症状が確認されることから、オートファジーの神経変性疾患における重要性が確立されています(8, 9)。a-synuclein凝集を認めるPDにおいて、USでは慢性骨髄性白血病治療薬nilotinibのオートファジー誘導作用による治療効果を検証する臨床試験が第3相まで実施されていますが、進行期PD患者では有意な薬効は認められませんでした(10)。現在、遺伝的背景を統一したPDにおいて、新たなオートファジー誘導剤(LRRK2阻害作用によるもの(11)、リソソーム酵素補充作用に期待するもの(PR001))などが米国を中心に治験中です。
以上の背景を鑑み、私は新たな薬理機序によるオートファジー促進薬の探索を進めています。特にリソソーム機能とオートファジーの関連に着目して検討を進め(12, 13)、2008年から順天堂大学にてPDモデル細胞・動物を利用し、新規オートファジー調節薬開発研究を進めています。その過程で、酸化ストレス時のオートファジー誘導に、新たなdynein複合体によるリソソーム分布調節機構を報告し(14)(図2)、この機序に基づく新たな創薬スクリーニングを行っています。また、液・液相分離に着目したオートファジー促進薬の開発を、井本正哉・笹澤有紀子・服部信孝(順天堂大)らと進め(特許特願2013-091903)、現施設ではこれら創薬シーズによる臨床研究を計画中です。
II. 研究手法の特徴
まずモデル培養細胞を用いた病態解析・治療薬候補の化合物スクリーニングを行い、疾患モデルマウス(主にPD)、及び遺伝性PD患者iPS細胞由来神経細胞(赤松和土(順天堂大学)、木田泰之(産総研))、いくつかのマウスモデルにて検証するという一貫したin vitro-in vivoシステムを用いています。
III. 大学院生募集
筑波大学医学医療系の共用施設としての共焦点レーザー顕微鏡やフローサイトメーターのフォローアップ体制が整っています。私が当教室に着任し、オートファジーアッセイシステムを含め、ハード・ソフトを整備しています。医歯薬学過程卒業者の博士課程(4年制)および修士(2年制)過程を含め、当教室を一つのステップとして更なる飛躍を遂げる意思を持った若い方たちに参加していただきたいと考えています。
(連絡先 斉木臣二 ssaiki@md.tsukuba.ac.jp)
IV. 主要論文
下記文献(1-7, 12, 14)を参照。
V. 主たる競争的研究資金(2015-)
文部科学省・日本学術振興会科学研究費補助金(研究代表者のみ)
1. 基盤研究B (一般、2022-2024)
2. 挑戦的研究(萌芽)
3. 基盤研究B (一般、2018-2021)
4. 基盤研究B (特設研究分野、2018-2020)
5. 国際共同研究強化B(2018-2021)
6. 日本医療研究開発機構橋渡し事業(慶應義塾大学拠点)(2017-2018)
7. 新学術領域研究領域提案型 計画研究(2013-2017)
8. 基盤研究B (2015-2017)
VII. 主な共同研究者(順不同, 敬称略)
赤松和土(順天堂大学ゲノム再生医療センター),天羽 拓(防衛大学校理工学群化学科),上野 隆先生(順天堂大学医学部生体機能部門),加賀直子(順天堂大学医学部生体機能部門),木田泰之(産業技術総合研究所),高 ひかり(順天堂大学医学部生体機能部門),服部信孝(順天堂大学神経学),松本拡高(長崎大学情報科学部),松本光晴(協同乳業株式会社主幹研究員),森 健策(名古屋大学情報学研究院),Viktor I. Korolchuk (Newcastle University)
参考文献
1. Annals of neurology 93, 303-316 (2022).2. Sci Rep 11, 18550 (2021).
3. Movement disorders : official journal of the Movement Disorder Society 35, 1438-1447 (2020).
4. Annals of neurology 86, 251-263 (2019). 5. Neurology 90, 404-411 (2018).
6. Sci Rep 7, 7328 (2017).7. J Neurol Neurosurg Psychiatry 87, 295-301 (2016).8. Nature 441, 885-889 (2006).
9. Nature 441, 880-884 (2006).10. JAMA neurology 78, 312-320 (2021). 11. Sci Transl Med 14, eabj2658 (2022).
12. Nat Cell Biol 13, 453-460 (2011). 13. Nat Chem Biol 4, 295-305 (2008). 14. EMBO J 41, e111476 (2022).
*1 後者は血中アミロイドβ濃度(MALDI-MSによる測定。https://www.shimadzu.co.jp/mass-research/news/7xfh6x2etinfwpcx.html参照)が病状把握に有用と考えられています。
*2 「皮脂RNAにパーキンソン病患者に特有の情報が含まれることを発見~ 皮脂RNA情報と機械学習モデルによる新たな検査方法の可能性 ~ 」(https://www.kao.com/jp/corporate/news/rd/2021/20210921-001/)
中馬越清隆
わたしは前庭機能や眼球運動、とくに眼位保持機構(神経積分器)をテーマに研究しています。動物とは異なり、人が人としての高次の精神活動(例えば本を読むなど)を行うためには、「じっくりと落ち着いてものをとらえて正確な視覚情報を得る作業」、つまり「固視」や「注視」をすることが重要となります。「固視」「注視」のために安定した眼球位置を保持するための脳内の神経機構は「眼位保持機構(神経積分器)」と呼ばれていますが(Robinson仮説)、まだ未解明な部分も多く残されています。疾患により脳内の眼球運動の制御システムが障害されると、安定した眼球位置や的確な眼球運動を行えず異常な眼球運動が出現します。よって異常眼球運動を調査研究することは、疾患の障害や進行を捉える臨床的側面のみならず、「眼位保持機構(神経積分器)」などの脳内の神経機構の解明につながると考えています。また眼球運動は人体のバランス制御と密接につながっています。視覚情報や皮膚や筋肉からの位置覚などの感覚情報の他、内耳の末梢前庭からの前庭情報が大脳の前庭皮質で統合され、最終的な出力情報が小脳・脳幹に投射されます。その結果、筋肉などの末梢効果器へ情報伝達され適切な運動でバランスが保持されています。この中で前庭経路は眼球運動制御に関与する重要な経路です。よって眼球運動障害の研究がバランス障害システムの解明につながり、疾患によるバランス障害に対する臨床応用が期待できると考えます。
Ⅰ.現在実施している研究
①大脳レベルでの「前庭メカニズム解明」についての臨床研究
実験動物を用いた基礎研究結果を背景に、アルツハイマー病や筋萎縮性側索硬化症、前頭葉側頭葉変性症などの中枢神経障害患者の眼球運動やバランス機能(前庭機能)を検出評価し、これまでに解明されている生化学、遺伝子レベルでの大脳の中枢神経障害メカニズムとの関連性を調査しています。
②前庭刺激による大脳賦活療法の開発
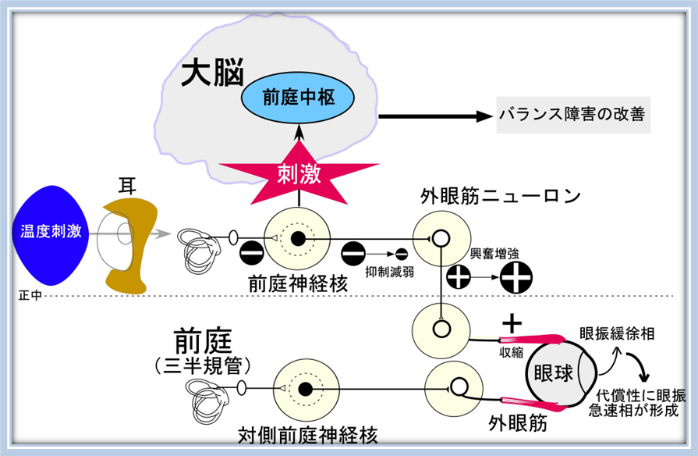
これまでに得た臨床研究結果から、中枢性前庭障害に対し、外耳道からの前庭刺激を介して大脳賦活化することで障害進行を予防する取り組み研究を予定しています。
Ⅱ.研究手法の特徴
日常診療で用いられる前庭機能検査を応用し、眼球運動解析を用いて疾患特異性や特徴を抽出し、臨床症状との関連性を評価する。実臨床に即した臨床研究であり、将来的にバランス障害の進行予防やリハビリテーションへの展開を目的としています。
主要論文
1. Science, 288, 857-859 (2000) 2. Neurology, 66, 131-132 (2006) 3. Neurotoxicology and Teratology, 37, 33-38 (2013)
4. Journal of the Neurological Sciences, 328, 98-101 (2013) 5. Journal of Alzheimer’s Disease, 47, 185-196 (2015)
6. Dement Geriatr Cogn Disord Extra, 6, 194-20 (2016) 7. Multiple Sclerosis and Related Disorders, 19, 59-61 (2018)
8. Journal of the Neurological Sciences, 397, 4-8 (2019) 9. Current Alzheimer research, 16, 293-301 (2019)
10. Current Alzheimer Research, 18, 1-7 (2021)
主たる競争的研究資金
1.基盤研究C(一般、2020 – 2022)2.筑波大学研究基盤支援プログラム(2017– 2018)
3.基盤研究C(一般、2014 – 2017)4.基盤研究C(一般、2011 – 2014)
冨所康志
アルツハイマー病(Alzheimer disease; AD)は認知症を引き起こす疾患の中で最も主要なものの1つです。超高齢化社会の進行している本邦ではADの根本的治療法(疾患修飾療法)の開発は喫緊の課題です。ADにより認知症を呈している患者さんの治療と診断は、現状では症候診断と対症療法ですが、神経病理学的変化を反映したamyloid-/tau PETや体液バイオマーカーによる補助診断のもとに根本的治療を行うとのコンセプトのもとで様々な疾患修飾薬が開発されてきています。
分子遺伝学的検討や遺伝子改変動物、ADとは異なったfamilial British dementiaやfamilial Danish dementiaなどといった脳アミロイドーシスと神経原性変化を呈する疾患群の解析などにより、ADにおけるAbペプチドの重要性が確立しました。更に、PETや脳脊髄液バイオマーカーの発展により、認知機能障害出現の20年も前から脳内でのAbの重合と沈着が始まり、やがてtauの重合と蓄積が生じ、シナプス・神経障害と認知機能障害を呈するというADの病態が既に明らかとなっています。そこで、軽度認知機能障害~軽度の認知症の段階でバイオマーカーを用いてADを診断し、抗Ab抗体を用いてADの疾患修飾療法を行うという試みがなされてきました。
ADにおける抗Ab療法は、虚血性心疾患に対する脂質異常症の治療や、糖尿病における全身合併症に対する血糖降下療法のようなものと考えることができます。抗Ab抗体療法については効果が限定的であることや高額な費用、治療前の診断など様々な点が議論されていますが、Abが前臨床期や軽度認知機能障害、軽度の認知症を呈しているADの治療標的となることが確立されればその意義は計り知れません。
冨所は大学院の学生の時代からこれまでAbを中心としたアミロイドペプチドの研究を一貫して行い、現在は、対照神経疾患の脳脊髄液も用いて前臨床期ADの段階を含めたAbとタウの関連の解明や、既存の薬剤のドラッグリポジショニングによる安価な抗Ab療法の候補の探索などを行っています。
藤巻基紀
I. 現在実施している研究
オートファジー/フェロトーシス軸(axis)に基づいた神経変性疾患の病態解明
背景
神経変性疾患とは、何らかの原因により脳や脊髄の特定の神経細胞が徐々に失われる疾患です。患者数が多くよく知られている疾患としては、アルツハイマー病やパーキンソン病があります。神経変性疾患は加齢に伴い進行するため、少子高齢化が進む中、病態の解明と治療方法の開発が強く求められています。
神経変性疾患の進行の原因として、近年オートファジーの障害が注目されています。オートファジーは細胞内のたんぱく質や細胞小器官などをリソソーム*1に輸送し、分解する仕組みです。脳や脊髄などの中枢神経は入れ替わることがなく、生涯にわたって神経活動を営みます。このため、オートファジーによる細胞内新陳代謝が、細胞の機能を保ち、神経変性を食い止めるために重要であると考えられています。
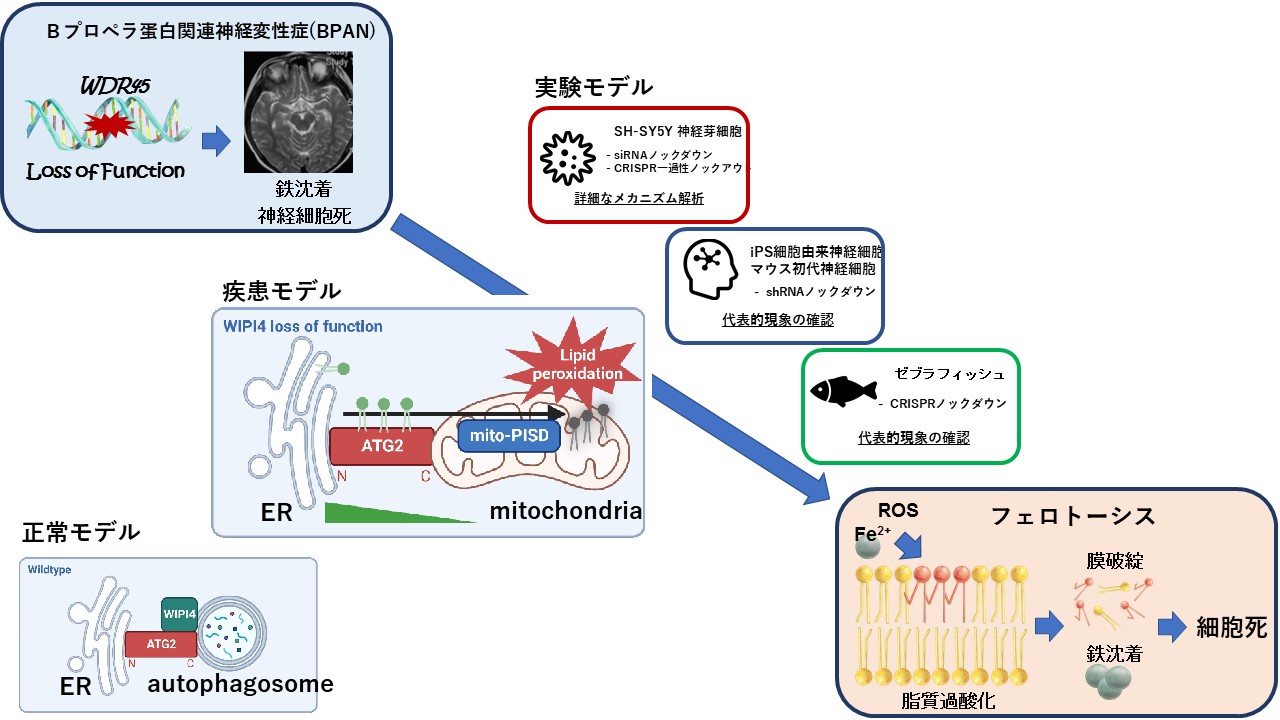
神経変性疾患の一種であるBPAN(β-propeller protein associated neurodegeneration)は、原因遺伝子であるWDR45から産生されるタンパク質WIPI4がオートファゴソーム*2の膜新生に関わるため*3、オートファジー障害との関連が疑われてきました。
a)BPANはオートファジー不全ではなく、鉄関連細胞死フェロトーシスにより生じるのか?
BPANは中枢神経に鉄貯留を伴う疾患群(Neuronal Brain Iron Accumulation:NBIA)の一種です。小児期に知的障害で発症し、成人期にジストニア*4やパーキンソニズム*5が急速に進行して、数年で寝たきりとなるという重篤な経過を辿ります。
私は英国ケンブリッジ大学*6に留学中に、BPANがフェロトーシスによって生じることを神経細胞・動物モデルで示し、Nature Cell Biology(インパクトファクター:28.213)に筆頭著者として発表しました(2024年2月26日現在in press)。
フェロトーシスは2012年にCell誌で発表された鉄関連細胞死で、鉄キレート剤を使用することで細胞死が抑制されたことから鉄が細胞死の中心を担っていると考えられたためFerro-と名付けられました*7。がん細胞は正常細胞に比較して鉄分子が非常に豊富であることから、フェロトーシスはがん細胞を選択的に細胞死に導く有効な手段になることを示す研究が数多くなされてきました。しかし次第にフェロトーシスの本体はリン脂質の過剰な酸化であることがわかってきました。さらに、細胞膜内で脂質と共に働くタンパク質であるαシヌクレインの異常や*8、脂質の酸化を制御するタンパク質であるホスホリパーゼA2の異常*9でも脂質の過酸化、フェロトーシスが誘導される可能性を示す研究が発表されるようになってきました。それぞれ、αシヌクレインはパーキンソン病の原因タンパク質、ホスホリパーゼA2は家族性パーキンソン病であるPARK14の原因産物であり、フェロトーシスが神経変性疾患に密接に関与している可能性を示唆します。
私はBPANにおける中枢神経内鉄貯留をヒントに、WIPI4が直接相互作用するオートファジー関連タンパク質の一つであるATG2A/Bが「リン脂質輸送タンパク質」であるというユニークな特徴に着目し*10、フェロトーシスがリン脂質の過剰な酸化により引き起こされていることから、BPANの原因がフェロトーシスであるという仮説をたてました。そして、遺伝子操作によりWIPI4の働きを阻害する*11と、ATG2A*12がオートファゴソーム上に適切に局在できなくなり、ミトコンドリアに過剰なリン脂質を誤って輸送してしまうことからミトコンドリア内で脂質の過酸化が誘導され細胞死フェロトーシスが生じるという機序を解明し、多様なモデルで証明することに成功しました(図1)。この研究はBPANの治療選択の機会を増やすだけでなく、直接脂質や鉄の制御に関わるタンパク質の機能異常でなくともフェロトーシスを誘導する可能性があるという新しい概念を提示できたことが評価されたと考えています。今後は患者さん由来のiPS細胞を用いた再現実験、脂質過酸化阻害剤による細胞死の抑制、血液・髄液中のフェロトーシス活性の測定など実臨床に応用できる研究を計画しています。
図1
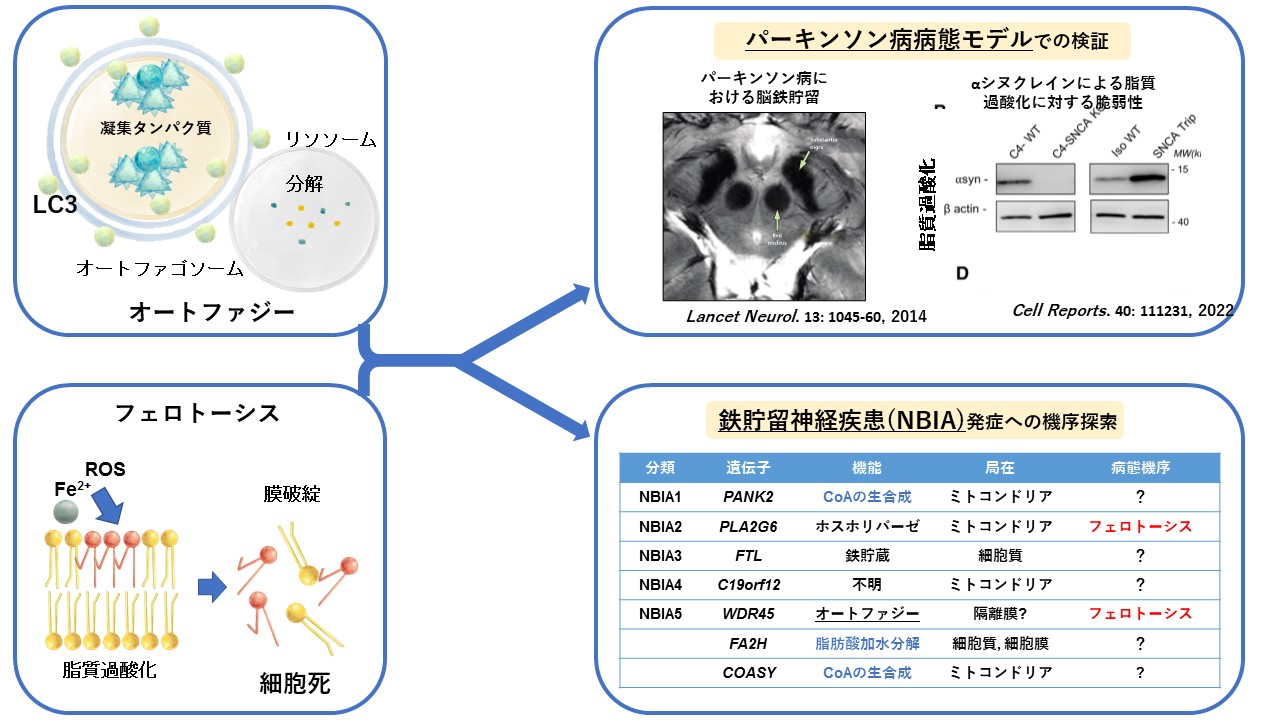
b) フェロトーシスはパーキンソン病、NBIAの病態に関与しているのか?(図2)
フェロトーシスはBPANだけでなく、パーキンソン病やNBIA(中枢神経に鉄貯留を伴う疾患群,Neuronal Brain Iron Accumulation)における神経変性にも関与していることが示唆されています。
パーキンソン病患者におけるフェロトーシス
パーキンソン病患者では進行により中脳黒質や大脳基底核に鉄貯留が見られるようになります*13。また、パーキンソン病の発症にはα-シヌクレインの凝集体が関わると考えられていますが、細胞実験レベルでは、αシヌクレインの量が増えると脂質の過酸化やフェロトーシスへの感受性が高くなることが示されています*14。以上からパーキンソン病のドパミン神経細胞死にもフェロトーシスが寄与しているという仮説のもと、下記のメソッドで詳細な臨床情報に紐づいた患者サンプルと細胞生物実験モデルで検証していく予定です。
- ①パーキンソン病患者の血清で質量分析により脂質の過酸化を定量(Malondialdehyde MDA, 4-hydroxynonenal 4-HNE)
- ②脳MRI画像(SWI)による中脳黒質の鉄沈着定量解析
- ③①-②に基づいたフェロトーシスの活性の推定
- ④同患者よりiPS細胞を樹立、ドパミン神経細胞を誘導し、in vitroでフェロトーシス活性を測定
- ⑤培養細胞PDモデルとしてαシヌクレインフィブリル導入SH-SY5Y細胞、MPTP処理SH-SY5Y細胞におけるフェロトーシス活性測定と機序探索
NBIAにおけるフェロトーシス
NBIA(中枢神経に鉄貯留を伴う疾患群,Neuronal Brain Iron Accumulation)は大脳基底核、大脳皮質などに過剰な鉄沈着をきたし、運動障害や認知機能障害など多彩な神経症状を呈する疾患であり、BPANもNBIAに属します。
NBIAのほとんどは依然原因が不明ですが、私の研究を含めてNBIA1-5のうち2つでフェロトーシスが病態機序であることが示されています(図2)。他のNBIAの原因となるタンパク質の機能も潜在的に脂質の制御に働くものが多く(図2機能:青)、さらにBPANと同様に著明な中枢神経鉄沈着という共通病理を有することからフェロトーシスとの関連が予想されます。現在それぞれのタンパク質発現をsiRNAノックダウンにより低下させ(ミニスクリーニング)、フェロトーシスが生じるかどうかを検証しています。
図2
細胞生物学は、これまでに誰も示したことのない病気・病態の本質に迫ることのできる非常に魅力的な分野だと感じています。特に患者サンプルにアクセスできる環境で研究を行うことで、発見した病態モデルを「患者さんの中で生じている病態」と照らし合わせることができることが大きな利点だと思っています。学部生・大学院生を問わず上記を含む細胞生物学研究に興味のある方は、斉木臣二教授までご一報ください。
- *1 細胞小器官の一つで、不要な物質を分解し、生体内恒常性の維持に寄与している
- *2 オートファジーの課程で現れる二重膜の細胞内構造。オートファゴソームがリソソームと融合すると、内容物が分解される。
- *3 WIPI4は、オートファゴソームの膜新生時に重要な役割を持つWIPI2のアイソフォームの一つで、オートファジーの過程の中で何らかの機能を持つことが予想されていました。
- *4 不随意で持続的な筋肉収縮。
- *5 ふるえや筋肉のこわばり、動作が遅くなるなど、パーキンソン病と似た症状のこと。
- *6 Cambridge Institute for Medical Research.
- *7 Cell 149(5): 1060-1072, 2012.
- *8 Cell Rep. 40(8): 111231, 2022.
- *9 Nat Chem Biol. 17(4): 465-476, 2021.
- *10 Nat Struct Mol Biol. 26(4): 281-288, 2019.
- *11 WIPI4をコードする塩基配列を人為的に欠失(ノックアウト)させたり、転写や翻訳を阻害(ノックダウン)した。
- *12 オートファゴソームの膜形性に関与するタンパク質。
- *13 Lancet Neurol. 13(10): 1045-1060, 2014.
- *14 Cell Rep. 40(8): 111231, 2022.
片浦哲志
I. 現在実施している研究
選択的オートファジーによる加齢・加齢性疾患の制御機構の解明
加齢はアルツハイマー病やパーキンソン病などの神経変性疾患の最大のリスク因子です。我が国の高齢化率は2050年に約40%にまで達すると推計され、加齢性疾患の患者とその家族はもちろんのこと、医療、社会、そして経済にかかる負担はどんどん大きくなっていくと考えられます。
私は加齢と神経変性疾患について、「オートファジー」を切り口に分子・細胞レベルで研究を行っています。オートファジーとは、細胞内の成分を分解工場であるリソソームへと運び、リサイクルする細胞の中の仕組みです。このオートファジーの機能の中に、特定のターゲットを選んで分解する「選択的オートファジー」があります。例えば、細胞のエネルギー工場であるミトコンドリアが損傷すると酸化ストレスの増加や細胞死など様々な悪影響があります。「マイトファジー」は、こうした損傷ミトコンドリアを分解する選択的オートファジーの一種です。
私はこれまで、マイトファジーがどのように制御され、そして細胞の健康維持にどのような役割を果たしているかを研究してきました。そして、マイトファジーが、酸化ストレスに応答して活性化される仕組み*1や、細胞内の補酵素NAD量の維持に重要であること*2,*3、これらの破綻が細胞死*2,*3や細胞の老化へつながる*4ことを明らかにしてきました。また、私は学部・大学院でケミカルバイオロジー研究を学び、パーキンソン病疾患を制御する低分子化合物の開発に取り組みました*5,*6. この経験を活かし、マイトファジーを中心に選択的オートファジーを制御する独自の低分子化合物の開発にも取り組んでいます*4。
現在は、選択的オートファジーがどのように細胞の加齢や細胞死を制御しているのか、その詳細な分子機構を、低分子化合物をツールに研究しています。同時に、これまでに同定した有用な低分子化合物について、パーキンソン病をはじめ、C型ニーマンピック病や異染性白質ジストロフィー(MLD)などの神経変性疾患治療に向けた応用研究を進めています。これら研究活動を通して、ヒトの健康寿命延伸の実現・加齢性疾患の治療法開発に貢献することを目指しています。

- *1 EMBO J 42 (5), e111372 (2023)
- *2 Dev Cell 57 (22), 2584-2598. e11 (2022)
- *3 Trends Cell Biol 33 (9), 788-802 (2023)
- *4 Dev Cell (in press)
- *5 Autophagy 17 (8), 1856-1872 (2021)
- *6 J Neurochem 155(1), 81-97 (2020)